

中国人民解放军总医院第五医学中心:研究开发的metaEVchip生物传感策略可用于血清中超灵敏的sEV分析
电子说
描述
纳米等离子体超表面技术以其高灵敏度而闻名,在癌症检测领域备受关注。然而,传统生物传感方法的数据处理和分析效率低下,阻碍了其潜力的发挥。
2025年9月23日,中国人民解放军总医院第五医学中心Li Bo、李伯安和厦门大学朱锦锋共同通讯在Advanced Science 在线发表题为“Deep Learning-Powered Nanoplasmonic Biosensing Approach Enables Ultrasensitive Extracellular Vesicles Profiling for Cancer Screening”的研究论文。该研究提出了一种基于柯尔莫戈洛夫-阿诺德网络 (KAN) 超表面芯片 (metaEVchip) 的生物传感策略,用于血清中超灵敏的小细胞外囊泡 (sEV) 分析。
通过基于 KAN 的深度学习纳米等离子体生物传感技术分析来自 600 例胰腺导管腺癌 (PDAC) 患者和 1200 例对照者的全光谱数据,该策略在外部验证集中实现了 0.99 的曲线下面积 (AUC),优于传统方法。进一步探索这种增强的性能,揭示了 KAN 同时捕获多维光谱特征的机制,这一优势能够实现高效的数据处理和准确性。这一进步大大扩展了纳米等离子体超表面在生物传感中的适用性,并为癌症筛查和改善多种恶性肿瘤的临床管理建立了新的范例。
胰腺导管腺癌 (PDAC) 是最致命的癌症之一,通常表现为晚期且无法切除,5 年生存率仅为 12%。早期发现可将生存率提高 30% 至 40%。目前,检测血清中的糖类抗原 19-9 (CA 19-9) 水平是 PDAC 最广泛使用的液体活检方法,但其敏感性和特异性不足,可能导致误诊或漏诊。这些局限性凸显了对更可靠诊断标志物的需求。检测血清中的小细胞外囊泡 (sEV) 是一种很有前景的替代方法,可提供卓越的非侵入性诊断方法。sEV 是由多种哺乳动物细胞主动分泌的纳米级膜囊泡,尤其是快速分裂的癌细胞。这些囊泡在血液中含量丰富,在介导细胞间通讯方面至关重要。与健康对照 (HC) 相比,肿瘤来源的 sEV 表面富含特异性蛋白质。例如,GPC1 和 EphA2 阳性 sEV 在区分胰腺导管腺癌 (PDAC) 与健康对照及其他疾病患者方面表现出较高的特异性和灵敏度。这些肿瘤特异性标记物有望克服 CA 19-9 的局限性,为 PDAC 提供更灵敏、更特异的诊断工具。
在此背景下,纳米等离子体超表面利用共振波长下的强局域电场增强,已成为一种强大的工具,可用于无标记、无损地识别各种生物样品。具体而言,分析物的固有特性会引起介电环境的变化,这表现为超表面响应中的波长偏移和强度变化。这些变化与分析物的浓度高度相关,从而为实现精确、灵敏的检测提供了可能。此外,折射效应 (RE)、光谱效应 (SE) 和纳米等离子体负载效应 (NLE) 分别从不同角度分析光谱响应,以阐明确定分析物浓度和类型的基础。然而,仅仅依赖单一的传感视角可能会导致宝贵信息的丢失,尤其是对于包含复杂大数据的纳米等离子体光谱,从而降低纳米等离子体生物传感的有效性。
相比之下,人工智能 (AI) 可以从多个领域提取数据特征,从而增强纳米等离子体光谱的模式识别能力,并提高纳米等离子体生物传感的效率。对于 sEV 光谱分析,由于纳米等离子体响应的高维性、连续性和物理相关性,有效捕捉细微的连续光谱偏移并解释多维特征的贡献仍然具有挑战性。为了解决这个问题,该研究采用了柯尔莫戈洛夫-阿诺德网络 (KAN),它通过基于样条函数的变换自适应地学习优化的激活函数。这种方法在建模光谱连续体方面具有卓越的能力,并且能够明确解释各个波长区域如何有助于预测,从而克服了传统 CNN 或Transformer 的主要局限性,这些传统 CNN 或 Transformer 在处理这种复杂的光谱数据时,往往会受到不灵活的归纳偏差或缺乏固有的可解释性的影响。
该研究提出了一种基于 KAN 深度学习的纳米等离子体生物传感方法,用于高灵敏度检测血清中的 sEV,从而促进 PDAC 筛查。该研究开发了一种晶圆级周期性纳米等离子体金纳米孔芯片,用于靶向高通量检测临床血清中的两种 PDAC特异性 sEV 膜蛋白(GPC1 和 EphA2)。获取的光谱信息进一步使用 KAN 深度学习进行全局分析。在此过程中,模型分析整个光谱以将每个信号分类为对照或 PDAC,特别突出了三个关键效应的演变。在实验中,研究队列包括 600 名PDAC 患者和 1200 名对照,包括一个独立的外部验证集(120 名 PDAC/240名对照),用于评估这种传感方式在 PDAC 中的诊断性能。对照组包括900例肝癌(HC)、100例胰腺炎患者、100例胆管癌(CCA)患者和100例肝细胞癌(HCC)患者。将模型输出与传统纳米等离子体传感方法下所有共振波长位置的单独和组合分析结果进行比较,结果显示诊断结果更佳。值得注意的是,与传统方法相比,基于KAN的纳米等离子体生物传感方法的曲线下面积(AUC)提高了58.9%。这些结果凸显了KAN驱动的深度学习纳米等离子体sEV平台在PDAC检测中增强的传感性能。此外,该研究开发的方法可以扩展到其他癌症筛查应用中的肿瘤特异性sEV分析。
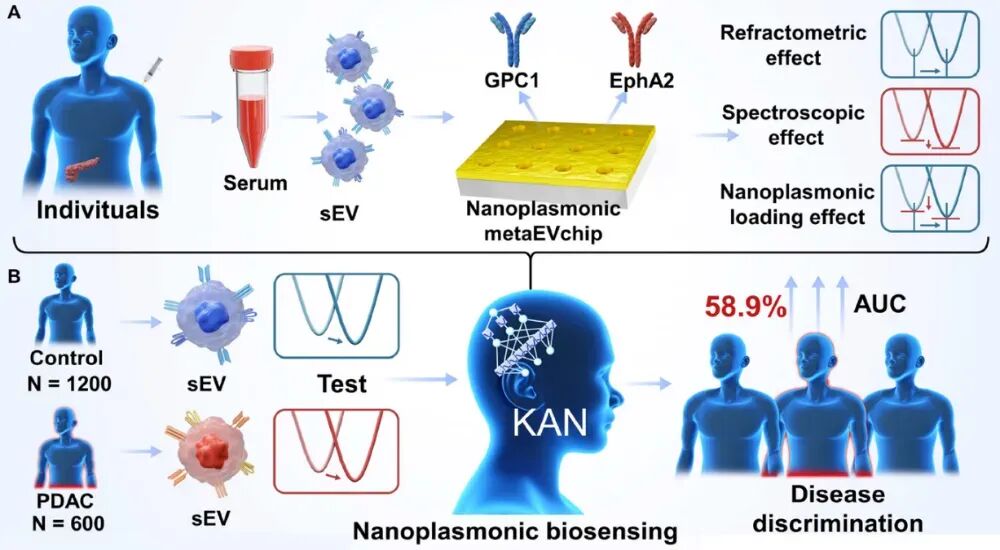
图1 KAN驱动的纳米等离子体生物传感方法示意图,用于sEV检测以促进PDAC筛查(图源自Advanced Science) 参考消息:
https://advanced.onlinelibrary.wiley.com/doi/10.1002/advs.202511337
来源:iNature
- 相关推荐
- 热点推荐
- 生物传感
-
中国移动携手华为助力解放军总医院成功完成了全国首例5G远程手术2019-03-18 1696
-
中国移动助力完成5G远程骨科人体手术2019-08-27 1415
-
中国人民解放军发射两枚东风导弹2020-09-28 6238
-
中亿睿55寸3.5mm液晶拼接屏打造天津中国人民解放军海军勤务学院平台2023-06-12 1245
-
中国人民解放军军事科学院军事医学研究院选购我司差示扫描量热仪2021-12-31 1394
-
全国首例!301医院云HIS系统国产化上线2023-11-17 1483
-
南京牧镭激光用激光雷达感知风速风向,一煤矿故意封堵传感器 ,3人被刑拘2024-04-03 1153
-
全球首例介入式脑机接口传感器血管内取出试验成功2025-01-08 1081
全部0条评论

快来发表一下你的评论吧 !

