

脑肿瘤治疗是否可以不用吃药?(超高频电刺激调控)
描述
肿瘤电池治疗发展历程概述
肿瘤电场治疗的发展历程源远流长。早在古希腊罗马时期,已有利用电鱼放电进行疾病治疗的记载。17世纪,肯内尔姆·迪格比首次记录了电场促进伤口愈合的现象。20世纪中叶后,研究分化为两条路径:一是低强度直流电被证实能促进伤口愈合并展现抑瘤潜力;二是交流电研究催生了介电泳与电穿孔等关键物理现象的发现。这些基础研究在21世纪初实现突破,Palti和Kirson团队发现特定频率的交替电场可选择性抑制癌细胞分裂,命名为"肿瘤治疗电场"。随着临床研究成功,Optune系统于2011年及2015年先后获FDA批准用于胶质母细胞瘤治疗,标志着这一非侵入性物理疗法的正式诞生,并持续向精准化、联合治疗方向发展。
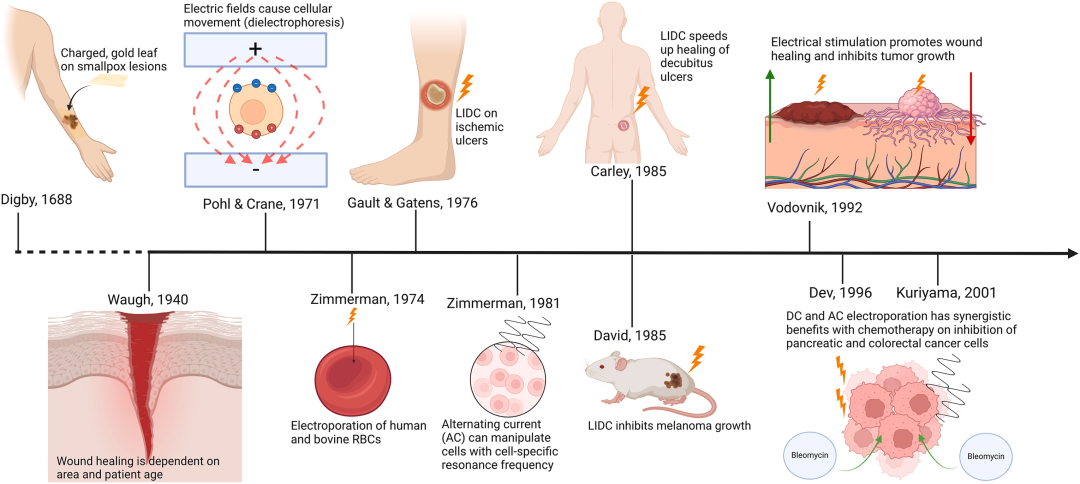
图1:电场医学应用与肿瘤治疗电场发展里程碑
图1 时间线图清晰地勾勒了电场在生物医学领域中从古代朴素实践到现代精准医疗的演进历程。它始于人类利用电鱼进行镇痛的古希腊罗马时期,历经17世纪带电粒子促进伤口愈合的早期观察,以及18世纪伽瓦尼与伏打对生物电理论的奠基。进入20世纪后,研究分化为探索低强度直流电(LIDC) 在组织修复与肿瘤抑制中的应用,与探索交流电 引发的介电泳 和电穿孔 现象两条主要路径,最终这些基础研究的汇聚,催生了现代肿瘤治疗电场(TTF) 技术的诞生,为TTF疗法提供了深厚的历史与科学理论基础。
HUIYING
肿瘤机理概述
胶质母细胞瘤(GBM)作为一种高度恶性的脑肿瘤,其核心机理在于肿瘤细胞的快速且不受控的分裂能力。正常GBM细胞分裂过程中,微管正常聚合,纺锤体组装完整(图2A),使得细胞能够顺利完成有丝分裂,导致肿瘤持续生长和侵袭。这种分裂过程依赖于细胞内极性元件(如微管)的空间定向和动力学,而肿瘤细胞由于其高分裂速率,对分裂过程的干扰尤为敏感。
HUIYING
肿瘤治疗电场疗法干预机理
肿瘤治疗电场(TTF)通过施加超高频(200–400 kHz)低强度(<2 V/cm)交替电场,干扰肿瘤细胞的分裂过程。其机制主要包括:
介电泳效应:电场对肿瘤细胞内极性元件(如微管)产生不均匀力,破坏纺锤体组装,导致有丝分裂停滞(图2B)。
电穿孔效应:增加细胞膜通透性,增强化疗药物(如替莫唑胺)的细胞内递送(图2C)。
多重辅助效应:包括诱导自噬、抑制细胞迁移、增加血脑屏障通透性以及调节免疫微环境(图2D)。 这些作用共同导致肿瘤细胞分裂延迟、凋亡增加,并增强对标准治疗的敏感性。
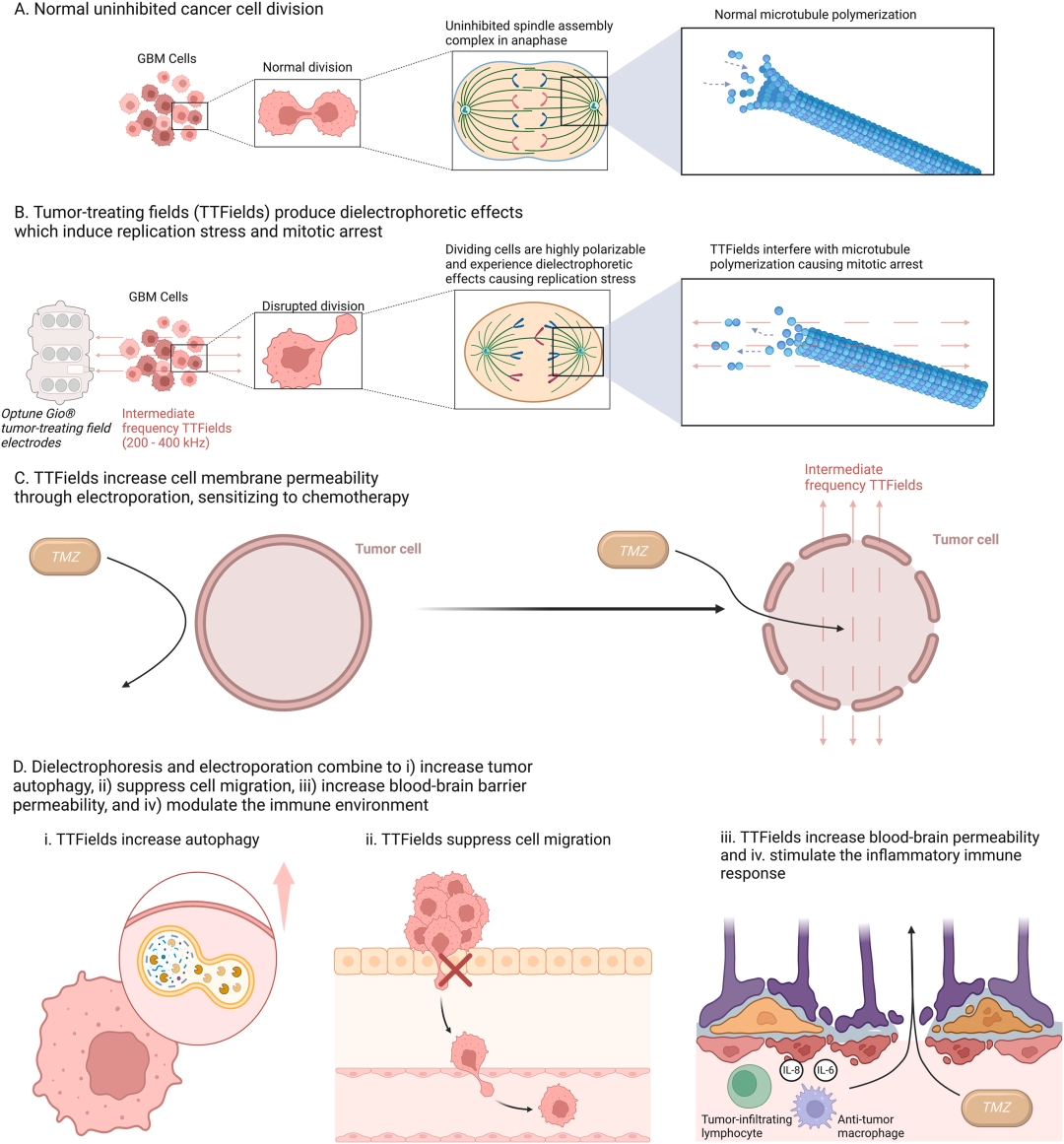
图2:肿瘤治疗电场抗胶质母细胞瘤的多重作用机制
图2 是理解TTF功能的核心,通过对比与分步演示,系统阐释了其多靶点抗肿瘤机制。A. 正常分裂: 作为对照,展示了GBM细胞正常、不受干扰的有丝分裂过程,包括正常的纺锤体和微管聚合。B. 介电泳效应导致有丝分裂灾难: 展示了TTF的核心机制——中频交替电场对细胞内高度极化的微管等结构产生不均匀力,破坏纺锤体组装,导致染色体分离错误,最终引起有丝分裂停滞和细胞死亡。C. 电穿孔效应增敏化疗: 直观地表现了TTF如何使肿瘤细胞膜出现暂时性的“孔洞”,从而增加像替莫唑胺这类化疗药物的渗透,提高药效。D. 多重协同效应: 概括了TTF的其他重要作用,包括诱导自噬、抑制细胞迁移、增强血脑屏障通透性以及调节免疫微环境。
HUIYING
侵入式与非侵入式肿瘤治疗电场疗法
核心机理:两者均基于中频交替电场的介电泳和电穿孔效应,但侵入式方法通过减少组织衰减优化电场递送。
硬件系统关键:
非侵入式:使用头皮电极阵列(如Optune Gio),包括陶瓷盘、水凝胶接触面和便携电池包。
侵入式:包括颅骨重塑(如颅骨切除术或钻孔)以降低阻抗(图3),以及颅内电极(如皮质表面阵列或瘤内调制电极,图4)。
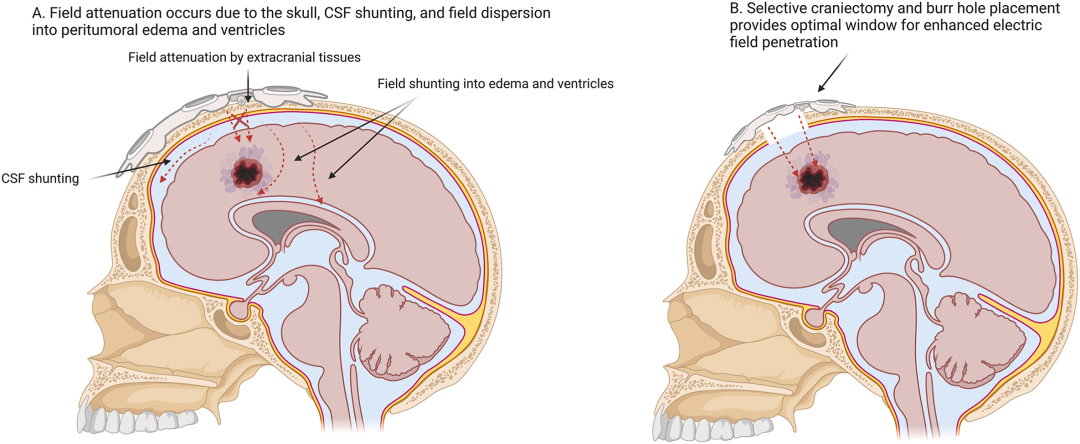
图3:电场分布优化策略图
图3 直面当前非侵入式TTF面临的核心挑战——电场衰减与分流。A. 传统TTF的局限: 描绘了电场在穿过头皮、颅骨时发生的衰减,以及电场被导电性更高的脑脊液、水肿液和脑室“分流”而远离肿瘤目标区域的问题。B. 手术增强策略: 展示了通过选择性颅骨切除术或分布式钻孔,移除了颅骨这一主要阻抗屏障,从而为电场创造了一个“窗口”,显著增强了到达皮层及皮层下肿瘤的电场强度和覆盖范围。图3: 解释了为何侵入式方法(如颅骨重塑)被认为是未来提升TTF疗效的重要方向,并通过对比清晰地展示了其物理原理和潜在优势。
参数与波形:
频率:100–400 kHz(典型200 kHz),波形为交替电流。
强度:非侵入式通常<2 V/cm,侵入式可通过局部递送实现更高电场密度。
刺激位点:
非侵入式通过个性化电极布局靶向肿瘤区域;
侵入式直接通过手术植入电极至肿瘤或邻近组织(如皮质表面或深部瘤体),实现精准覆盖。
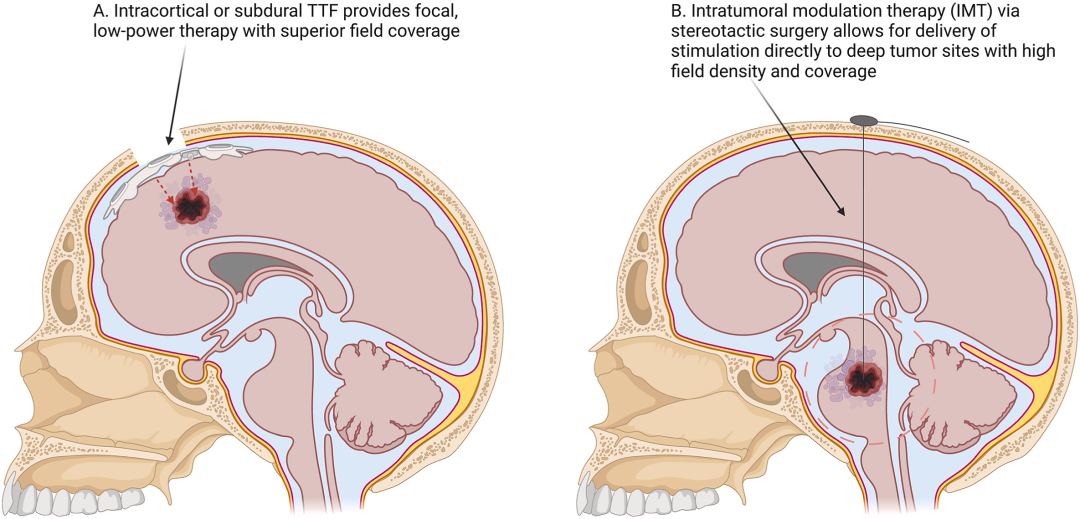
图4:侵入式疗法模式图
图4 进一步展望了比颅骨切除术更深入的侵入式TTF疗法。A. 皮质表面/皮层内TTF: 展示了将电极阵列直接放置于大脑皮层表面或插入皮层内(类似犹他阵列),从而完全避免颅骨和头皮的衰减,以极低的功耗实现肿瘤区域的精准、高强度电场覆盖。B. 瘤内调制疗法: 展示了通过立体定向手术将DBS样电极直接植入深部肿瘤内部。这种方式特别适用于手术难以触及的深部脑区(如脑干、丘脑)的肿瘤,能够产生高度局域化的治疗电场。图4 描绘了TTF疗法未来的前沿发展方向,即通过更精准、更直接的电场递送方式,攻克当前非侵入式疗法在深部肿瘤和电场分布上面临的难题。
HUIYING
临床研究:详细分析与阐述
研究方法
TTF疗法的临床验证主要基于一系列前瞻性、多中心的随机对照试验,其中EF-14试验是具有里程碑意义的关键三期临床试验。
研究设计与人群:EF-14试验招募了新诊断的胶质母细胞瘤患者,这些患者在经历最大程度的安全切除术后,已完成标准的放化疗(同步替莫唑胺)。随后,患者被以 2:1 的比例随机分配至两组:
实验组:接受TTF疗法联合辅助替莫唑胺治疗。
对照组:仅接受辅助替莫唑胺治疗。
研究终点:
主要终点:无进展生存期。
次要终点:总生存期。
统计方法:采用意向性治疗分析。除了主要分析外,还进行了探索性的Cox比例风险模型分析,对已知的预后因素(如卡氏评分、MGMT启动子甲基化状态、年龄、手术切除范围等)进行了调整,以确认TTF的独立疗效。
研究结果
生存效益显著:
无进展生存期:与单独使用替莫唑胺相比,TTF联合治疗显著延长了中位无进展生存期(6.7个月 vs. 4.0个月)。风险比为0.63,这意味着联合治疗组的疾病进展或死亡风险降低了37%。
总生存期:联合治疗同样显著延长了中位总生存期(20.9个月 vs. 16.0个月)。风险比同样为0.63,表明死亡风险降低了37%。
长期生存率:联合治疗的效益在长期随访中更为突出。两年总生存率在联合治疗组达到43%,而对照组仅为29%。这一数据在GBM这种侵袭性极强的癌症中具有重要的临床意义。
剂量-效应关系(依从性至关重要):
研究明确揭示了TTF疗效与每日使用时间之间存在强烈的剂量-效应关系。
分析显示,在治疗前六个月,每日使用时间≥18小时的患者,其中位总生存期达到22.6个月,而使用时间较短的患者为19.1个月。
这表明TTF需要近乎连续地施加电场才能最大程度地干扰肿瘤细胞分裂,高治疗依从性是实现最佳疗效的关键。
安全性及生活质量:
安全性特征:TTF疗法的全身性副作用与替莫唑胺单药治疗相似,但其独特的不良反应主要集中在局部。
皮肤反应是最常见的问题,包括轻度至中度的接触性皮炎、溃疡或感染。在临床试验中,约52%的患者报告了皮肤相关不良事件。这主要是由于需要长期在头皮上佩戴电极阵列所致。
图2 所展示的Optune Gio电极阵列,直观地说明了与皮肤直接接触的硬件部分,是导致这些局部反应的原因。
生活质量:尽管存在皮肤不适的挑战,但一项针对EF-14试验患者生活质量的二次分析得出了令人鼓舞的结论。与单独化疗相比,TTF联合治疗组在整体健康状况、身体功能和情绪功能方面的“无恶化生存期”显著更长。这意味着,尽管需要佩戴设备,但患者能够更长时间地维持较好的生活质量。唯一的例外是皮肤瘙痒,TTF组恶化得更早,这与其安全性特征相符。
HUIYING
总结
肿瘤治疗电场疗法(TTF)代表了胶质母细胞瘤治疗的重要进展,通过非侵入性中频电场干扰肿瘤分裂机制,与标准化疗联合可显著延长患者生存期。未来方向聚焦于优化电场分布,包括侵入式方法(如颅骨重塑和瘤内调制)以增强深部肿瘤覆盖,以及结合免疫疗法等其他模式。尽管存在皮肤副作用等挑战,TTF在改善生存质量和疗效方面展现出巨大潜力,需进一步研究验证其长期安全性和广泛适用性。
-
超高频示波器的原理和应用2025-01-03 738
-
超高频电子学基础-369页2025-05-28 383
-
图书馆RFID超高频、高频标签应用对比2011-07-14 5105
-
超高频读写器 UHF RFID 电路设计2011-11-24 3599
-
【EMC家园】超高频RFID电子标签2016-01-15 3821
-
基于51单片机的超高频rfid模块2017-03-31 4220
-
【专业解答】超高频RFID标签如何选型?2017-07-26 2780
-
射频卡分类和超高频身份识别应用优势2018-09-05 2029
-
高频与超高频RFID应用之间的区别概述2019-06-19 4628
-
怎么设计超高频RFID标签?2019-08-26 3123
-
哪些物质会影响RFID超高频电子标签的性能?2020-04-01 2313
-
超高频身份识别应用优势是什么?2021-05-21 1657
-
用于治疗脑肿瘤和癫痫的新型柔性传感器2022-02-26 952
-
巧测超高频管fr参数2009-08-12 1199
-
多维度分析高频和超高频RFID技术区别2022-01-08 1995
全部0条评论

快来发表一下你的评论吧 !

