

数字微流控技术的基本原理芯片结构及在生物分析中的应用说明
描述
近20年来,随着微全分析系统(Micro-total-analysis syste, μTAS)和芯片实验室(Lab-on-chip, LOC)概念的提出,微流控技术的兴起对分析科学乃至整个自然科学体系的发展产生了巨大的推动作用。微流控技术作为一种基于微尺度效应的流体处理技术,其核心理念是通过构建微纳器件将复杂的实验室功能集成于单个分析设备或芯片上,实现分析系统的微型化与集成化。常规的微流控芯片以微通道为主体,通过阀、泵等外部构件实现对通道内微流体的操作和控制。然而,此类芯片结构复杂,加工难度大;需要外置泵、阀配合使用,难以集成化;易产生通道“死体积”,引起交叉污染。因此,近年来对微液滴操纵与控制新方法的研究成为国际微流控领域的研究重点。
数字微流控技术(Digital microfluidics, DMF)是一类新型液滴操纵技术的统称,常见的驱动法有介电润湿、介电泳、声表面波、静电力、磁力等。本文中DMF特指介电润湿型的液滴操纵技术,其利用液滴在疏水化表面的介电润湿现象,通过控制微电极阵列上液滴接触角变化,实现离散液滴的精确控制。相比于传统基于微通道的微流控芯片,DMF技术既保留了样品消耗量少、热转换快速,以及具有高并行性和自动化的能力,同时不依赖微泵、微阀或微混合器等元件,甚至无需复杂的三维流体通道,具有构建简单、可动态配置的优点,因此特别适用于高集成度、高性能、操作复杂的生物、化学微全分析体系。
本文基于分析化学的视角对现阶段DMF技术的发展进行了总结,同时分别在液滴驱动理论、芯片构建及具体应用等方面加以阐述。
数字微流控理论基础
介电润湿(Electrowetting-on-dielectric, EWOD)是指通过改变绝缘基板之间电压,来改变基板上液滴的润湿性(即改变接触角),使液滴发生形变、位移的现象。其机理主要有两种①Lippmann的能量观点,即微液滴与介电层之间电荷积累产生的电容效应导致能量变化,引起微液滴表面张力改变从而使得接触角变化。该理论用Lippman-Young方程描述EWOD现象,此方程由Berge在20世纪90年代通过合并Lippmann方程和Young方程得出:
cosθ = cosθ0 + ε0εrV2 /( 2γɖ)
式中, ε0表示真空介电常数;εr表示导电液滴的相对介电常数;γ表示气/液表面的张力系数;ɖ为介质层厚度;V为驱动电压;θ0和θ分别表示施加驱动电压前后的接触角大小。由于该理论提出较早,相关的理论体系成熟,因此为多数人所接受。然而该理论无法解释低表面张力液体无接触角变化、不对称EWOD效应、接触角饱和效应等现象。基于此,2000年Digilo等提出了基于电动力学的EWOD理论,主张微液滴三相接触线上电荷累积产生的静电力导致微液滴毛细管线张力改变,从而引起接触角变化。该静电力可用 Maxwell-Stress张量Tij表示(式2),其中,i和j分别为x、y和z轴的函数,δij为张量积δ,E为液滴周围的电场。该公式解释了不经历接触角变化的液滴运动。
Tij=ε(EiEj-0.5δijE2)
基于介电润湿的DMF技术最早由杜克大学的Fair等和加州大学洛杉矶分校的Kim等分别提出。以双平板为例(图1B),上板接通零电极,下板的电极接驱动电压,液滴位于左右两个驱动电极之间,当右侧电极导通时,由式(1)可知,微液滴处于施加电压的电极表面一侧湿润性发生改变,液滴左右两侧的接触角不同,其内部产生的压力差驱动微液滴沿着施加电压的电极方向运动。按时序给驱动电极施加电压,即可驱动微液滴沿着预设的路径运动,实现对微液滴的操控。
数字微流控芯片的结构与构建
图1B中描述了DMF设备的两种常见模式:单平板模式(也称为开放式)和双平板模式(也称为封闭式)。在单平板模式中,液滴直接负载于同时含有驱动电极和地电极的单个基板上;在双平板模式中,液滴被夹在两个有电极的基板之间。通常上板是一个由连续透明的导电铟锡氧化物(ITO)层形成的地电极,下板有一系列刻蚀好的驱动电极阵列。在这两种模式中,下板均涂有绝缘介质层,且所有表面均被一层疏水性涂层覆盖。两种设备通常在空气中运行,但越来越多的研究人员使用硅油等不与液滴混溶的材料作为填充介质,用以防止液滴挥发、减小液滴操纵所需的驱动电压。虽然两种模式的驱动原理类似,但单平板模式不能实现液滴的分裂及生成,而双平板模式得益于三明治结构对液滴的剪切力,可以实现液滴的生成、分裂、混合和移动,因此具有更广泛的应用。
图1 数字微流控(DMF)芯片示意图
A、DMF芯片上液滴操纵,包括混合、分裂、合并和生成;B、不同结构DMF示意图
芯片结构的设计是DMF芯片实现液滴操纵功能的基础。以双平板模式为例,下板中驱动电极阵列主要分为储液池电极、反应区电极及连接两者的连接电极。储液池电极面积较大,用于存储反应试剂,并通过连接电极的逐级牵引实现液滴的生成。所生成液滴的体积由其被牵引到的最后一个电极的面积控制,体积的均一性受被操纵的电极形状和电极数目影响;反应区电极是DMF芯片的主体部分,通过在反应区电极上的液滴操纵实现不同的功能,所需要的功能越复杂,反应区电极数目越多。针对不同目的,可在反应区电极上进行多层结构加工,包括纳米探针、温控模块或三电极体系等,这是不同的DMF芯片结构上最大的区别。
在DMF芯片中,基板材料决定了芯片的加工过程和电极阵列的设计。玻璃优良的化学惰性使之成为DMF芯片基板的首选。然而复杂的加工过程和高昂的价格使其难以大规模推广。近年来,将造价低且易批量生产的印刷电路板(Printed circuit board, PCB)用作DMF芯片的基板受到众多研究人员的推崇,这是因为多层PCB板的构建解决了玻璃和硅片芯片基板电极与外接点间布线困难的问题,使得大规模电极阵列的构建成为可能。此外,包括纸、柔性材料等基底的引入使得DMF芯片可应用于不同需求。表1总结了现阶段DMF芯片常用的基底及其优缺点。
DMF芯片的电极一般由金属或其它导电材料构成。介电层用于促进电荷的积累和增加电场强度,以保证易于驱动液滴且不会造成击穿。根据材料的不同,可选择气相沉积(派瑞林、氮化硅、非晶氟聚合物、热生长(二氧化硅)、旋涂(聚二甲基硅氧烷、光刻胶)等不同方法形成介质层。疏水层一般是含氟聚合物(聚四氟乙烯),用于减少液滴驱动的表面能。
表1 DMF芯片的种类及优缺点

数字微流控的应用
数字微流控技术作为一种通用性的新型离散微流体处理平台,拥有许多独特优势,因此在生物分析领域中得到了广泛应用。
基于核酸的应用
分析DNA样本或表征前,必须先进行纯化和提取。Sista等利用注塑成型的聚碳酸酯作为上板, PCB作为下板,使用首款集成型盒式双平板DMF芯片从遗传损伤样本中提取出人类基因组DNA。首先,将全血液滴与含有细胞裂解液的液滴混合,然后引入含DNA捕获磁珠的液滴将细胞溶解产物中的DNA捕获,通过磁铁的辅助分离出磁珠,用缓冲液反复清洗实现分离和纯化。该款集成DMF芯片具有可自动进样、易操作、反应区大等优点,因此引起了广泛关注。DMF设备也被用于DNA转染反应,Madison等将Ti∶Au电穿孔电极集成于DMF芯片的下板上,通过脉冲放电的形式对混合后分别含质粒DNA和大肠杆菌的液滴进行电穿孔,从而使质粒DNA转染进大肠杆菌体内。这种基于DMF的电穿孔设备可实现多次自动化的连续转染,操作简单、反应快速,对于基因工程的亚微米尺度化发展起到了积极的作用。
聚合酶链式反应(Polymerase chain reaction, PCR)是通过控制温度和催化酶活性在不同温度下完成三步循环反应的过程,是分子生物学中最强有力的工具之一。2010年,Hua等发展了一种全自动多通道DMF设备用于多路qPCR实验,该设备使用集成型盒式DMF芯片(图2A),并将反应所需的温度控制、磁响应模块和荧光检测构件等集成于系统中(图2A左)。将在体外使用磁珠提取的耐甲氧西林金黄色葡萄球菌基因组DNA注入该装置,可通过连续的磁珠富集、液滴移动和混合操作使基因组DNA与PCR混合物混合,并利用液滴在两个热源之间的不断运动实现温度循环(图2A右),即能够实现4路qPCR反应的同时进行。该系统利用DMF传热快、热稳定性好的优势,通过简单的液滴操纵实现了复杂的温度循环,且能检测到相当于低至单个细胞基因组的样品量,同时扩增效率达94. 7%以上。
将DMF应用于DNA测序是一个新兴的研究领域,而焦磷酸测序作为一种边合成边测序的方法,可通过连续的液滴混合分裂方式监测其化学发光信号。Welch等利用简单的T字型芯片结构验证了DMF上的焦磷酸反应实验:在3个储液槽中分别放置反应所需的样品、底物和酶,首先从储液槽中分配出包含某一单一类型核苷酸底物和酶的液滴,并将其移至包含固定单段DNA样品的位置。液滴孵化一段时间后将其移动到CCD相机下观测化学发光信号,通过对磁珠的清洗即可进行下一次的反应。随后,Boles等将该体系进一步集成化,并进行了DMF上的焦磷酸测序,在测序长度、测序精度和测序通量方面有了显著提升。
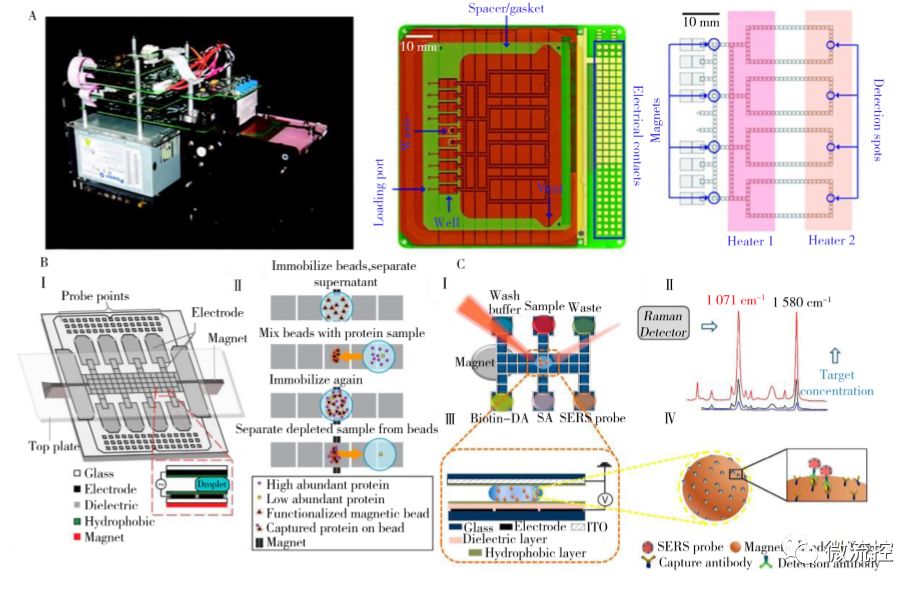
图2 DMF在生物大分子研究中的应用
A、一体化多路real-time PCR DMF芯片及设备;B、用于蛋白质提取的具有自动化磁分离体系的DMF芯片:(Ⅰ)磁铁处于磁分离的位置时设备层的横截面图、(Ⅱ)DMF芯片上进行自动化蛋白质提取的流程;C、SERS-DMF免疫分析原理:(Ⅰ)SERS-DMF芯片俯视图、(Ⅱ)拉曼信号分子4-MBA特征峰、(Ⅲ)SERS-DMF芯片截面图、(Ⅳ)带SERS探针的免疫复合物结构图
蛋白质组学
蛋白质组学实验过程中,在利用质谱或其他检测器分析前通常需对大量样本进行多次处理,DMF具有的阵列式并行操控能力使其在蛋白质组学研究领域获得了广泛应用。早期主要使用DMF平台用于复杂基质中蛋白或多肽的纯化,芯片结构基本为无表面修饰的双平板模式,在其上进行多步的磁珠富集、清洗及液滴混合等基本操作即可完成实验。Mei等使用偶联有anti-HSA、Protein A和Protein G的磁珠捕获缓冲液中的人血浆蛋白,通过简单的液滴混合和磁珠分离即可完成DMF上的自动化蛋白质提取(图2B, Ⅰ)。该八通道芯片使用独特的条状磁棱镜技术,可在10min内同时处理4个样品,且IgG和HSA的提取效率达95%以上(图2B, Ⅱ),使基质辅助激光解吸附质谱(MALDI-MS)的信噪比提升了近4倍,这种快速和自动化的提取方法大大提高了样品处理的集成度和样品检测的灵敏度。
免疫分析与临床诊断
免疫分析是利用抗原和抗体的特异性反应进行检测,在临床诊断和生化分析中具有广泛应用。 然而常规免疫分析耗时长、成本高、操作复杂,且检测设备较大。而DMF技术具有的分析速度快、试剂和样品用量少、易集成化和自动化等特点在一定程度上能克服传统免疫分析的缺点。Yang等设计了包裹有拉曼信号分子的核壳结构纳米颗粒Au@MBA@Ag,该颗粒具有表面增强拉曼信号放大功能,可作为酶联免疫吸附体系ELISA中的信号输出(图2C, Ⅳ)。当有靶标流感病毒H5N1存在时,修饰有捕获抗体的磁珠和SERS颗粒的探针会与靶标形成三明治结构,用缓冲液清洗未结合的纳米颗粒后,将芯片置于拉曼检测器下即可实现检出(图2C, Ⅱ)。该款芯片可将反应试剂和反应操作自动化,并减小反应试剂体积,实现了流感病毒H5N1的快速、灵敏和线上一体化分析,并能够用于血清复杂样本的直接高灵敏检测(图2C, Ⅰ、Ⅲ)。
临床诊断相比于正常的免疫分析更加注重实际样本的检测能力与准确度。Martin等首次证明了DMF芯片与生理体液的兼容性,建立了一种使用DMF在人类乳腺组织匀浆、全血和血清样本中处理和提取雌激素的方法。该实验将样本溶解使雌激素被提取到极性溶剂中,其他成分被提取到非极性溶剂中。从样本中提取的雌激素用LC-MS和ELISA进行监测和量化,在提取量相同的条件下,该方法的样本容量比传统方法小1000倍,速度快20倍,因此有望用于乳腺癌的筛查与预诊。Rackus等发展的纸基液体吸收预浓缩方法(P-CLIP)将高吸水能力的滤纸置于储液槽中,在磁棱镜控制捕获有靶标分子磁珠的情况下,将微升甚至毫升级的样品拖动至滤纸处,通过其吸水能力使得样品体积大幅减小,同时不损失样品中的靶标分子。该方法能够完成大体积生理样品的直接上样分析,使得DMF的适用环境更加广阔。
基于细胞的应用
DMF由于具有可寻址性和高灵活性,相比传统的微流控芯片更便于进行各种细胞的培养和分析,因此被广泛应用于细胞相关领域的研究。Barbulovic-Nad等在2010年首次实现了芯片上哺乳动物细胞的培养,通过在上板疏水表面滴加纤连蛋白在芯片上得到局部亲水的结构,当液滴通过该结构时会产生子液滴。使用该方法拖动含有细胞的液滴,残留于子液滴中的细胞沉降后即可贴附于芯片表面上,并完成细胞消化(图3A, Ⅰ、Ⅱ)和换液(图3A, Ⅲ、Ⅳ),培养时间长达5 d以上。Wit-ters等使用湿法Lift-Off技术改进了DMF芯片上疏水化表面局部亲水的方法,实现了结构可控的DMF芯片上局部亲水化图案的制备,完成了DMF芯片上黏附细胞的单细胞、多细胞及细胞团的表面固定(图3B)。
近年来,随着单细胞分析的快速发展,研究人员开始尝试在DMF上进行单细胞分析。Wheeler 等首次开发了基于DMF的免疫细胞化学平台,利用上板亲水结构捕获细胞,然后引入试剂流经细胞对其靶蛋白和磷酸化蛋白标记,取下上板进行后续的染色和微阵列扫描即可实现血小板来源生长因子受体(PDGFR)磷酸态的应激响应过程研究(图3C)。2015年,Rival等将细胞悬液大量稀释后直接生成液滴得到1~3 个细胞,利用磁珠捕获实现了mRNA的捕获、纯化和一步 qRT-PCR,该方法使用多层光刻技术构建了纳升级的反应体系,有望用于单细胞转录组测序文库的制备(图3D)。
总结与展望
本文总结了DMF技术的基本原理、芯片结构及其在生物分析领域的应用。DMF在诸多领域中均表现出明显优势,特别是在核酸处理、临床诊断和细胞分析等方面,可在一个设备上完成复 杂样品的预处理和高通量分析。随着以PCB为基底的DMF芯片进一步精良化、高通量化,以及可替换膜技术和快速打印技术的发展,DMF会变得更价廉、易得而且液滴驱动、检测和分离等新技术的不断改进,也会对DMF的发展与集成起到促进作用,使DMF设备变得更通用和集成, 更易于与其他仪器联用。此外,由于DMF技术本身以模块化和寻址性作为设计基础,因此可在一个芯片上通过软件配置实现多靶标的组合分析,有望在即时检测领域得到进一步的应用。
然而,现阶段DMF技术仍受制于加工成本高、技术要求高、稳定性差等问题,使得其普及度低, 应用场景有限。DMF设备的复杂制造过程和商业仪器的缺乏,也进一步导致仪器使用度低,短时间内难以快速推广。尽管DMF技术不够成熟,但仍在不断改进,随着大规模生产技术的发展和通用DMF仪器的发展,其在分析化学和其他领域将有很大的发展潜力。
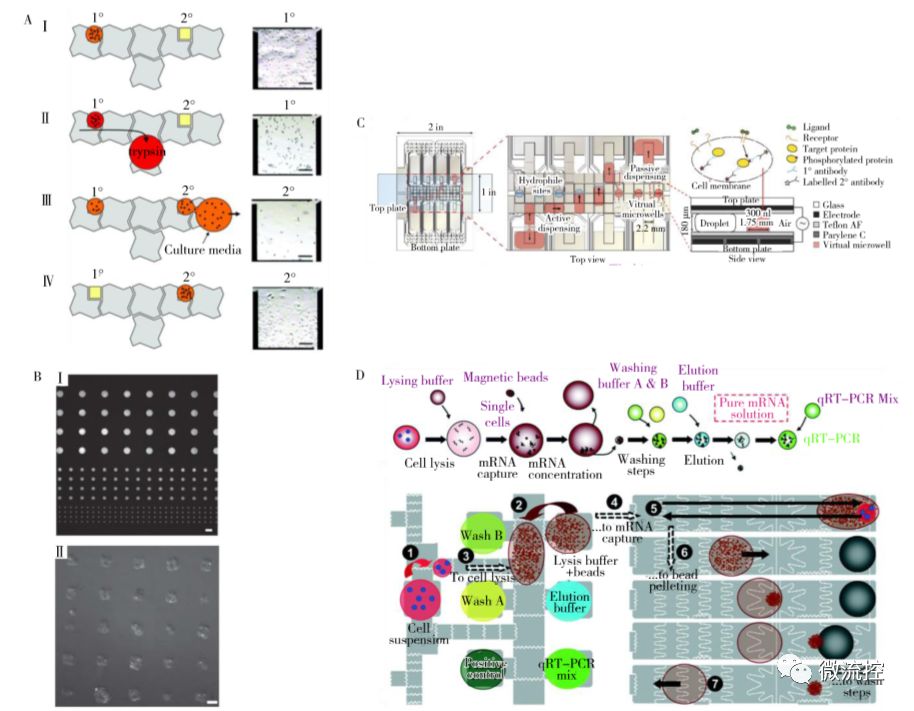
图3 基于细胞的应用
A、DMF上含CHO-K1细胞子液滴的形成及培养;B、Teflon-AF表面FITC标记的PLL荧光图案;C、用于单细胞分析的DMF免疫细胞化学平台;D、DMF上单细胞用于基因表达分析的mRNA提取、纯化和RT-PCR流程
-
技术解析:微流控芯片为什么这样强大?2015-04-16 18898
-
新技术在生物样本冷冻中的应用案例分析2023-12-26 3831
-
微流控分析芯片2018-06-22 2404
-
微流控生物芯片的磁场仿真及实验对比2010-01-11 1007
-
表面等离子共振技术在生物医学中的应用2011-02-11 817
-
微流控芯片技术详解_微流控技术在生物医学上的应用2018-05-28 47752
-
浅析微流控技术在生物传感检测领域的应用2018-10-04 7635
-
微流控芯片组成结构2019-01-29 32963
-
锁相放大器在中微流控应用的详细说明2022-01-24 895
-
点成生物展出微流控芯片、压力泵等产品,分享微流控芯片技术应用方案2022-08-01 2780
-
综述:基于类酶材料的微流控技术在生物分析方面的应用2022-12-21 1735
-
电压放大器在液滴微流控芯片的功能研究中的应用2023-02-14 1421
-
电压放大器在生物微流控中的应用研究2023-09-15 962
-
优可测推动微流控技术革新,精准助力生物医学等行业的发展2024-01-19 1120
-
高通量生物分析技术之微流控芯片2024-11-14 1154
全部0条评论

快来发表一下你的评论吧 !

