

中科院半导体所和山东大学联合设计了一种声表面波细胞裂解器件
描述
【背景介绍】
细胞裂解是获取细胞内蛋白,细胞器以及遗传物质等物质的关键步骤。通常,细胞裂解可通过物理方法,化学方法以及生物方法来实现,例如超声裂解,酸碱裂解和酶裂解等。这些方法通常需要大量的细胞样品或较长的裂解处理时间,这对其应用产生了限制。近年来基于微流控的细胞裂解方法发展迅速,为微量细胞样品快速高效裂解提供了平台。虽然在微升液滴尺度上进行实验可以显著地降低样本的消耗以及裂解所需要的时间,但是这些方法通常也需要外电场或者裂解酶等特定结构或试剂来辅助裂解,其集成性和应用性依然受限。因此生物检测领域对于具有普适性的微量细胞快速裂解的方法依然有迫切需求。
近年来,基于声表面波的微流控技术在细胞分选以及生化传感方面大放异彩。声表面波是一种由射频信号在压电基片上激发的弹性波,其波长处于微米量级,是一种理想的在微纳米尺度进行细胞操控和处理的工具。目前,基于声表面波的微量细胞裂解方法主要是通过声场中的剪切力裂解以及声压裂解来实现,可以在高功率下实现有效的细胞裂解。然而,为获得剪切力需要构建的声子晶体结构制备复杂,而声压破碎又有相当大的功耗以及不稳定性,导致其在进一步集成应用上具有较大限制。因此,如果能够通过引入纳米或者微米量级的颗粒,使其与尺寸相近的细胞进行相互作用,由此产生的相互作用力就有望使细胞在较低的功率下实现裂解,实现低成本的细胞裂解,将会具有非常大的实用意义。
【成果简介】
近日,中央民族大学耿照新教授、中科院半导体所陈弘达研究员和山东大学刘宏教授联合设计了一种声表面波细胞裂解器件,可以实现多种细胞在微量液滴中的高效裂解,并对裂解原理和机制进行了详细的阐释介绍。该器件仅由压电基片铌酸锂(LiNbO3)衬底及其上的一对平行叉指电极(IDTs)和一端的双层3M胶带组成,其中叉指电极周期为120 mm,为了减少杂波生成,在叉指电极上设计了80个声波周期。进行裂解时,仅需在胶带前滴加5-20 mL包含有微粒和细胞的混合液滴,随后通过可调节的信号源在基片上产生行波声表面波,在基片上传播的声表面波将会耦合到含有微米颗粒和细胞的液滴中,产生声流场,带动声流场中的微粒和细胞运动。由于微粒和细胞具有不同的物理性质,在曳力作用下产生不同的加速度,因而在声流场中反复经历加速、碰撞和再加速的过程,在细胞-微粒界面处由于碰撞时巨大的动量交换产生强大的相互作用力使得细胞膜功能丧失,实现细胞裂解。经过对试验条件的优化和多种细胞裂解的尝试,找到了最优的裂解条件,实现了100%的细胞裂解。通过细胞膜胞内蛋白以及细胞核的三种荧光的裂解前后荧光对比证明了细胞裂解后胞内蛋白得到有效释放,可用于后续生化传感过程。针对不同种类微粒的裂解实验,通过扫描电镜图片捕捉并且通过模型还原了碰撞界面以及碰撞过程,通过流体动力学计算估算了不同细胞和微粒在声流场中的受力分析及加速度参数。通过与其他微量细胞裂解方法比较,说明了该方法在微量细胞裂解中具有巨大新意以及应用价值。研究成果以题 “Piezoelectric Microchip for Cell Lysis through Cell-Microparticle Collision within a Micro Droplet Driven by Surface Acoustic Wave Oscillation”作为封底(Back Cover)发表在Small上。该成果在学术流中得到众多学者认可,并有多位学者要求进行合作,开展其在“干细胞、神经元细胞”、“外泌体、微泡”、“蛋白、MircoRNA”等方面的研究。
本文第一作者是山东大学博士生王世才,在耿照新教授负责的“新材料与新器件”小组开展具体工作,刘宏教授也参与全程指导。本项工作受到国家重点研发计划“声表面波材料与器件”以及“微纳生化传感材料与器件”的支持。
【图文导读】图一、器件制备和表征
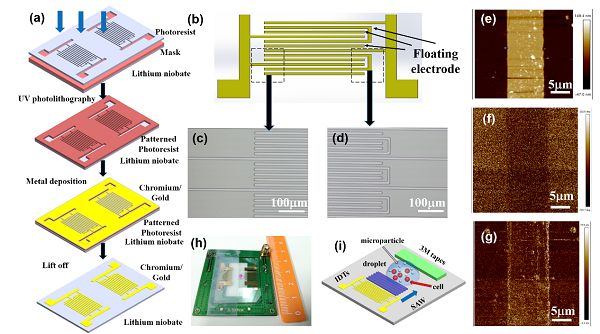
(a)器件制备示意图。
(b)电极设计示意图。
(c)电极光刻显微镜图像。
(d)电极光刻显微镜图像。
(e)压电力显微镜(PFM)图片。
(f)PFM下的振幅高度。
(g)PFM下的相位图。
(h)器件实物图。
(i)器件示意图。
图二、裂解原理
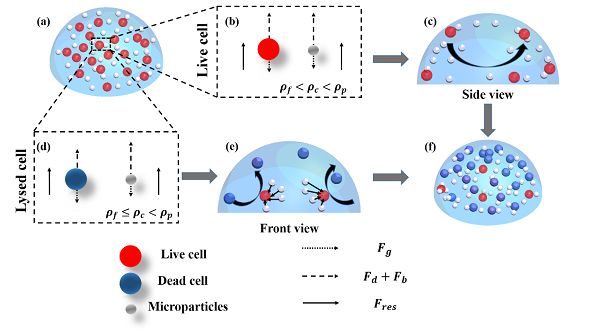
(a)裂解前液滴中微粒与细胞分布。
(b)活细胞受力分析。
(c)声场中细胞与微粒受力与运动侧视图。
(d)死细胞受力分析。
(e)声场中细胞与微粒受力与运动主视图。
(f)裂解后细胞与微粒在液滴中的分布。
图三、裂解影响因素的探索
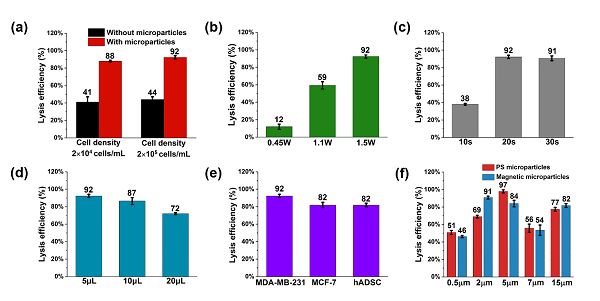
(a)在直径为4 mm的磁珠存在与否的情况下的细胞裂解效率。
(b)不同裂解功率下细胞的裂解效率。
(c)不同裂解时间下的细胞裂解效率。
(d)不同液滴体积下的细胞裂解效率。
(e)相同条件下,MDA-MB-231,MCF-7和hADSCs的裂解效率。
(f)直径为0.5, 2, 5, 7, 15 mm的PS球和磁珠的颗粒的细胞裂解效率。
图四、细胞裂解前后的荧光染色图片。
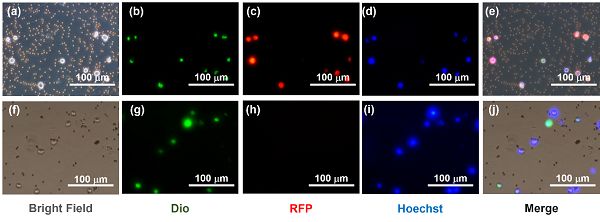
(a)细胞裂解前的明场图片。
(b)细胞裂解前的Dio细胞膜染色图片。
(c)细胞裂解前的RFP胞内蛋白分布图片。
(d)细胞裂解前的Hoechst细胞核染色图片。
(e)细胞裂解前的叠加图片。
(f)细胞裂解后的明场图片。
(g)细胞裂解后的Dio细胞膜染色图片。
(h)细胞裂解后的RFP胞内蛋白分布图片。
(i)细胞裂解后的Hoechst细胞核染色图片。
(j)细胞裂解后的叠加图片。
图五、不同种类和尺寸下裂解细胞的扫描电镜图像及其对应的模型分析
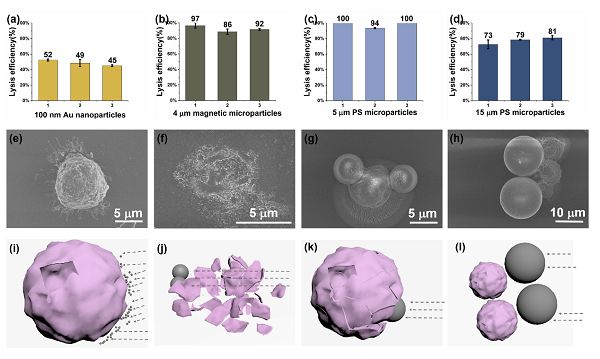
(a)100 nm Au颗粒作用下的细胞裂解效率。
(b)4 mm 磁珠作用下的细胞裂解效率。
(c)5 mm聚苯乙烯微流(PS)作用下的细胞裂解效率。
(d)15 mm PS作用下的细胞裂解效率。
(e)100 nm Au颗粒作用下的细胞扫描电镜图片。
(f)4 mm 磁珠作用下的细胞扫描电镜图片。
(g)5 mm PS作用下的细胞扫描电镜图片。
(h)15 mm PS作用下的细胞扫描电镜图片。
(i)100 nm Au颗粒作用下的细胞裂解碰撞模型。
(j)4 mm 磁珠作用下的细胞裂解碰撞模型。
(k)5 mm PS作用下的细胞裂解碰撞模型。
(l)15 mm PS作用下的细胞裂解碰撞模型。
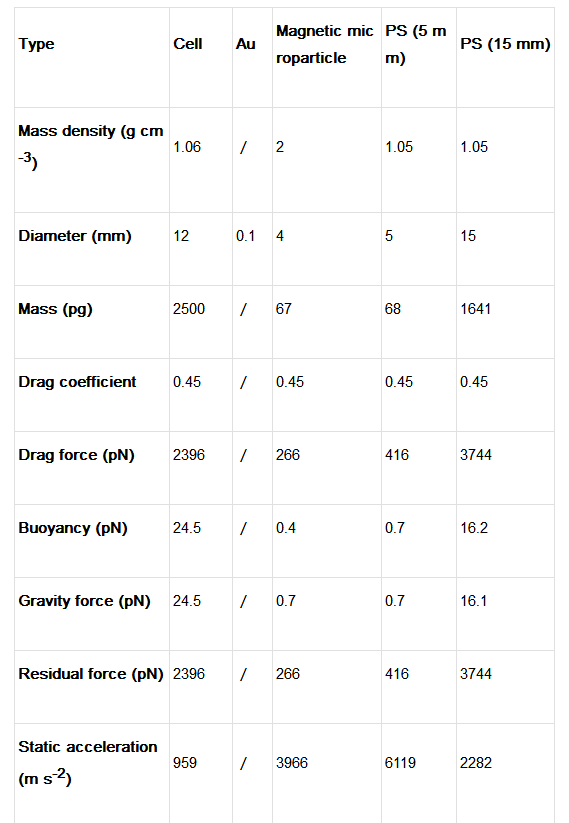
表一、微粒参数和流体力学分析
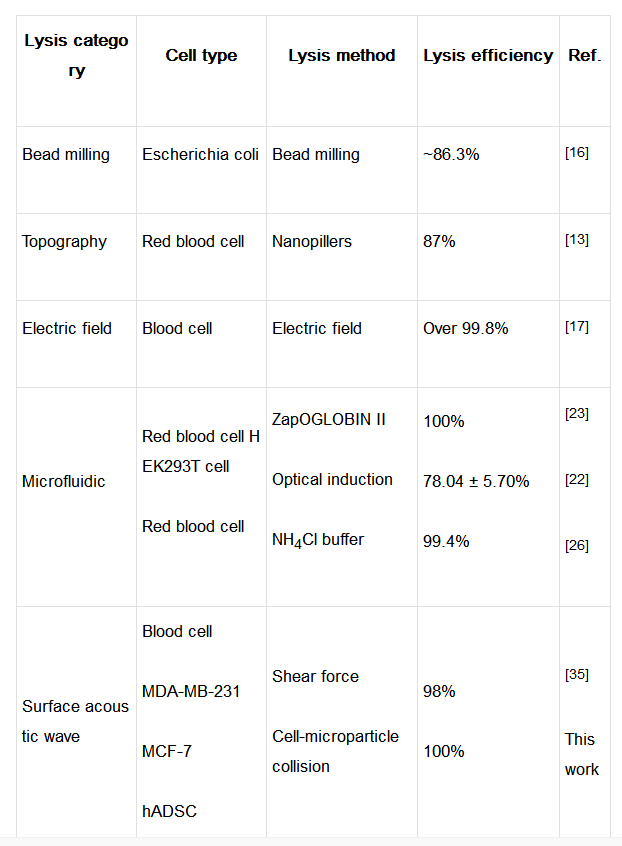
表二、与其他微量细胞裂解方法的效率对比
【小结】
总的来说,研究人员通过向含有细胞的液滴中引入微米颗粒,利用声场对细胞和微粒的不同加速作用实现了细胞和微粒的碰撞,实现细胞的高效裂解。荧光实验证明经过裂解,胞内蛋白得到有效释放,为胞内物质检测提供良好的基础。因此,作为一种新型微量细胞裂解方法,该器件在癌症检测,细胞组分分析,干细胞研究等方面具有关键性的意义。
-
集成电路设计基础.ppt(山东大学教程)2011-11-22 14244
-
中科院剖析 LED怎样克服困难2012-07-18 8268
-
【精品】山东大学飞思卡尔单片机教学电子课件2013-04-02 92797
-
声表面波无源无线传感器详解2018-10-24 4916
-
用于气体检测的声表面波振荡电路设计2018-11-05 2128
-
声表面波器件的封装技术及其发展2018-11-23 3175
-
基于声表面波器件的无线远距识别系统的实现2010-12-06 523
-
基于声表面波的某无线远距识别系统的实现2006-03-24 1334
-
基于声子晶体的声表面波器件研究2011-05-30 1867
-
中科院半导体所成功研制视觉芯片2011-09-15 1615
-
我国研究人员解决了声表面波器件在高频段工作时具有较高的输出功率的问题2018-01-18 6635
-
一种秒级响应的新型声表面波氢敏器件2019-11-30 3915
-
山东大学-算能RISC-V研究院正式揭牌,助推集成电路产业新发展!2023-10-17 1397
-
山东大学选购我司一批热分析仪设备2023-12-01 975
-
致谢山东大学:携手并进,共创辉煌2024-08-29 595
全部0条评论

快来发表一下你的评论吧 !

