

科研人员利用靶向纳米载体激活并杀死 HIV病毒
电子说
描述
“激活并杀死”(“Shock and Kill”)是近年来提出的治疗HIV的热点研究之一。该疗法针对难以根除的HIV潜伏库,旨在先激活再消灭,从而达到最终消除病人体内病毒的目的。然而,该疗法在多项临床试验中屡屡碰壁,疗效和安全性均未能达到预期效果。在最新发表在Science Advances的一项研究中,科研人员利用靶向纳米载体试图去解决这个疗法存在的一些主要障碍。
研究背景
目前对于人类免疫缺陷病毒(HIV)感染的治疗手段仍然局限于服用多种抗逆转录病毒药物(又称“鸡尾酒”疗法)。该疗法虽然可以有效抑制病毒复制,却无法彻底根除那些潜伏在宿主细胞的病毒。这些病毒寄宿在人体的正常免疫细胞中却不表达复制,使得药物和自身免疫系统无法识别并消灭这些感染细胞。近年来,研究人员们提出了“激活并杀死”的治疗概念,并开展了多项临床试验(总结见综述Cao and Woodrow, Eur. J. Pharm. Biopharm. 2018. doi:10.1016/j.ejpb.2018.06.002)。该治疗手段利用一些潜伏激活剂(latency-reversing agents, LRAs) 去重新激活这些潜伏细胞,同时患者持续服用抗病毒药抑制激活病毒的复制并防止其他健康细胞被感染。这些被激活的细胞往往会因为本身的病毒感染而自行凋亡或者被自身免疫系统清除, 研究人们也在尝试结合其他手段去更有效的“杀死”这些激活细胞。但是,针对数十种免疫激活剂的临床实验却不尽如人意,患者体内的潜伏病毒量并没有出现预期中的降低,而且这些激活药物还可能引发一些非特异性的免疫激活从而导致毒副作用。
针对这一疗法的局限性,位于西雅图的华盛顿大学Prof. Kim Woodrow组开发了特异性靶向CD4淋巴细胞的磷脂包裹的聚合物纳米载体。该系统具备以下一些特性:
可以同时递送物理化学属性不同的药物。这点对于需要多种药物协同作用的抗病毒手段尤其重要,近期的研究同样表明单一的潜伏激活剂不足以有效激活潜伏病毒,需要多种药物协同作用。
通过物理作用包裹药物或者化学共价键结合实现药物的缓控释放。
100 nm左右的粒径使得纳米载体通过皮下注射后可高效率地被淋巴组织吸收,而纳米粒表面的CD4抗体能够特异性靶向到HIV的主要宿主细胞CD4淋巴细胞。这些被动和主动的靶向作用能够更有效地将LRA递送到靶向组织和细胞,从而降低对于其他不相关联的淋巴细胞的激活作用,在提高疗效的同时降低毒副作用。
主要成果
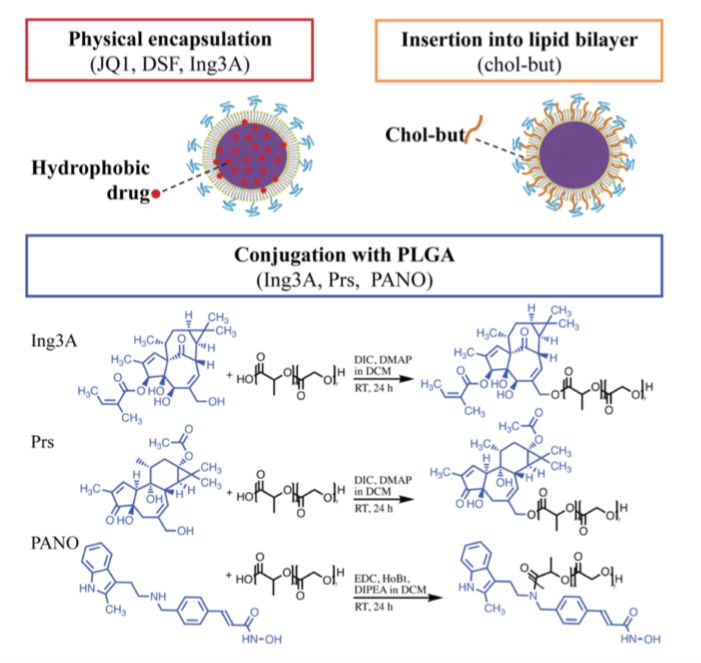
研究人员从已报道的LRA中选出了毒副作用小药效高的LRA进行实验,并根据这些药物的理化性质不同利用3种手段搭载到纳米载体中(包裹在聚合物内,插入磷脂外壳中,或者与聚合物共价结合)。之后研究人员对于这些搭载不同LRA药物的纳米粒在HIV潜伏细胞系模型(J-Lat A1)中进行筛选,比较几种药物的体外释放,激活效果以及细胞毒性。通过对比这几种不同的LRA,发现其中Ingenol-3-angelate (Ing3A) 的药效最高,同时JQ1,prostratin和Ing3A都表现出了低细胞毒性。研究人员接着对于这些LRA两两组合的协同效应进行了实验和比较。首先是在细胞系中进行筛选,通过Bliss独立性模型发现了多种两两结合的LRA具有协同效应(尤其包括JQ1在内的组合)。再通过比较两两组合的疗效和细胞毒性,最终锁定了JQ1与Ing3A为最佳组合。接下来, 通过与西雅图福瑞德哈金森肿瘤研究中心Florian Hladik组的合作,研究人员利用 病毒抑制期中的HIV感染者提取的血液细胞进行HIV激活实验。结果表明筛选出的JQ1和Ing3A组合显著激活了淋巴细胞内潜伏的HIV病毒,而相同浓度单一药物却无法达到激活效果。相比于游离药物组合,药物搭载的纳米粒显示出了同样优良的协同激活作用。
靶向纳米载体的一大优势是能够将药物输送到特定的组织和细胞。 HIV潜伏细胞多数正是隐藏在淋巴组织里的CD4淋巴细胞,因而对于通过常规给药途径给予的游离药物来说,很难在靶细胞和靶组织中达到有效药物浓度。在这个研究中,科研人员进一步优化了纳米载体,发现粒径在100 nm左右表面带负电荷的纳米粒子更容易在给老鼠皮下注射后蓄积到周围的淋巴结组织,而很少进入全身的血液循环。接着,科研人员将CD4抗体接在了纳米粒表面,并用豚尾猕猴的血液细胞证实了CD4的选择性激活特性。当将接有CD4抗体的纳米载体给老鼠皮下注射后的1-3天中,发现CD4靶向特性同时还提高了纳米粒在淋巴结的蓄积和停留。
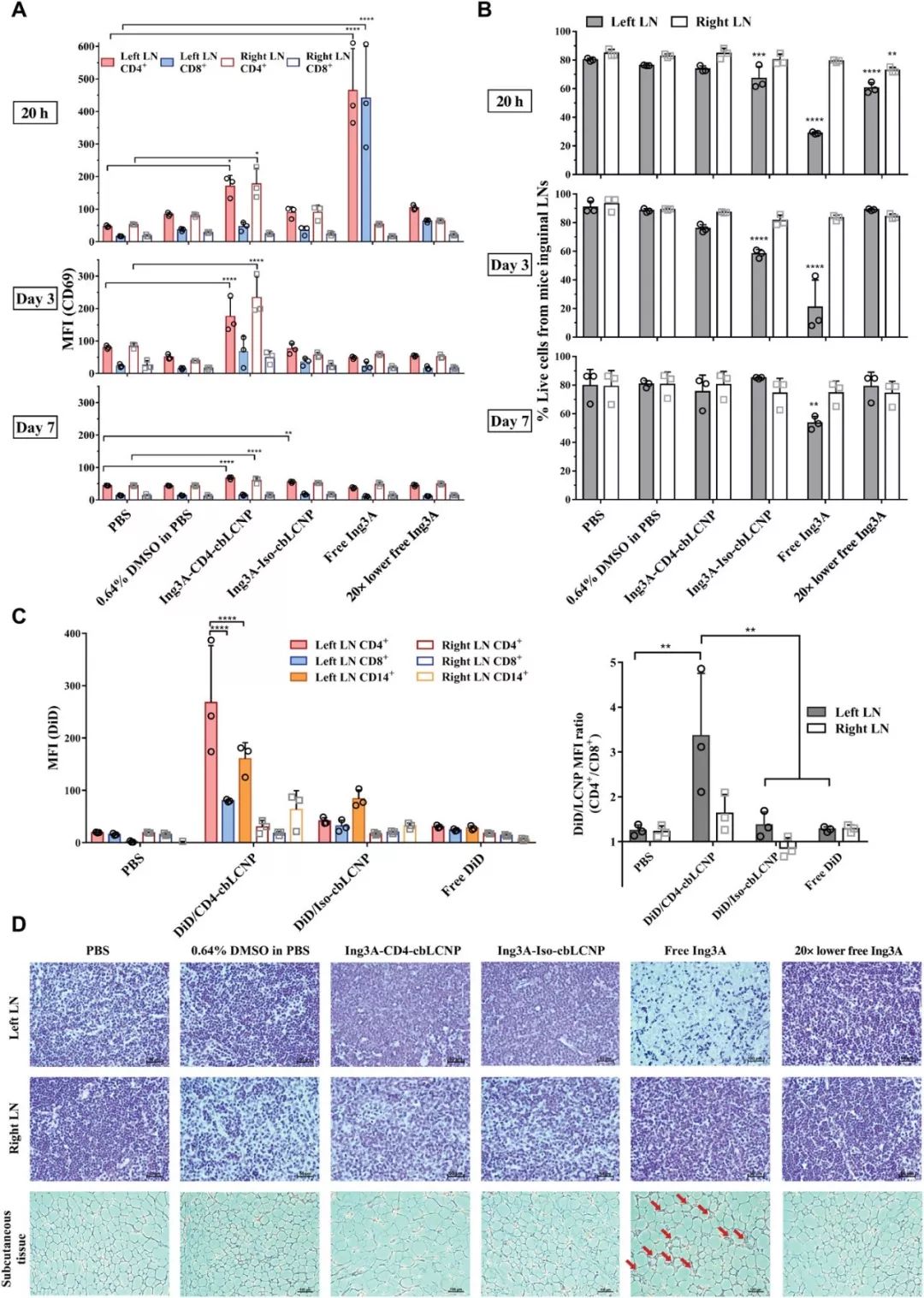
研究人员接着比较游离Ing3A (Free Ing3A) 和携带Ing3A的靶向纳米粒 (Ing3A-CD4-cbLCNP) 在老鼠模型上对于淋巴结CD4细胞的激活作用。游离药物只在注射后20小时对于注射附近的淋巴结内的细胞有激活作用,并且该作用同时作用于CD4和CD8细胞,没有选择性,激活作用时间仅持续一天。而对于CD4靶向的纳米粒,在注射位点附近和远离注射位点的淋巴结中的细胞均观察到了激活效应,并且仅有CD4细胞被激活,而CD8细胞没有被激活。并且这一效应一直延续到注射后的第7天 。体内的荧光示踪实验同时证实了靶向纳米粒在淋巴结CD4细胞中的高分布。在这个实验过程中,研究人员意外发现游离的Ing3A引发了老鼠注射部位组织的炎症反应,同时导致附近的淋巴组织中大量细胞死亡,而注射后含Ing3A的靶向纳米粒的老鼠却没有观察到任何不良反应和细胞凋亡的现象, 证明了该靶向纳米粒可以通过缓控释以及靶向递送显著降低药物毒副作用。
此文章于美东时间3月27日在线发表于Science Advances,第一作者为华盛顿大学生物工程系博士生曹世杰,通讯作者为该系副教授Kim A. Woodrow。该项目前后获得了amfAR(艾滋研究基金会)共计150万美元的资助,目前正由华盛顿大学,福瑞德哈金森肿瘤研究中心以及路易斯安纳大学的研究人员合作, 在猕猴体内做安全性和药物动力学的研究,之后还将在SIV感染的猕猴动物模型上进行药效学的研究。该项目同时获得美国国立卫生研究院(NIH)的资助。
-
NVIDIA GPU助力科研人员探索外星世界2025-02-27 901
-
热像仪助力生命科学研究—肿瘤细胞靶向治疗(二)2022-07-07 1406
-
热像仪助力生命科学研究—肿瘤细胞靶向治疗(一)2022-07-05 1497
-
纳米孔靶向测序精准检测病毒2020-07-11 2832
-
科研人员提出可加速AI的计算与存储器混合技术吗2020-05-21 2571
-
最新研发的纳米材料或可杀死新冠病毒,未来用处广泛2020-04-12 7013
-
美国研究人员正研制一种新型口罩材料 可在几秒钟内阻止并杀死病毒2020-04-10 3242
-
一份有关中国科研人员数据管理和数据分享习惯的报告2019-02-20 5717
-
NIST科研人员研制出可模拟神经网络的硅光芯片2018-08-21 3990
-
芬兰科研人员推出极度精准的传感技术:采用量子位与机器学习!2018-07-10 3806
-
俄罗斯科研人员正在研制一种核能医疗电池,使用期可达100年2018-07-05 874
-
艾滋病疫苗最新消息:荧光激活细胞分选术助力HIV疫苗取得突破2017-05-27 2047
-
静电纺再生丝素纳米纤维研究2014-12-25 4036
-
中科大发现源于纳米天线效应的新电光现象2010-04-24 1812
全部0条评论

快来发表一下你的评论吧 !

