

电解池的设计及标准与电化学重要公式及应用举例
描述
电解池的设计及标准
电解池的主要应用用于工业制纯度高的金属,是将电能转化为化学能的一个装置(构成:外加电源,电解质溶液,阴阳电极)。使电流通过电解质溶液或熔融电解质而在阴,阳两极引起还原氧化反应的过程。
1. 电解池设计的一些标准
1) 电解池体积
体积要适当,同时要选择适当的工作电极和溶液体积之比,在多数电化学测量中,需要保证溶液本体浓度不随反应的进行而改变,这时就要采用小的工作电极与溶液体积之比;在有些测试中电解液有限,那就只能尽量减小电解池的体积;在某些测量中,如电解分析中,为了尽可能短时间内使溶液中反应物电解反应完毕,应使用足够大的研究电极面积和溶液体积之比。因此要根据具体情况确定溶液体积,选择合适的电解池。
2) 电解池材质
玻璃是常用的电池材料,其在大多数无机溶液或有机溶液中都很稳定,但是在HF溶液、浓碱中不是很稳定,此时可以用聚四氟乙烯,它具有很好的化学稳定性,在浓碱与王水中均不发生变化,同时也不溶于有机溶剂,使用温度范围-195 ℃~250 ℃。
3) 电解池用隔膜
工作电极和辅助电极体系之间的电流密度尽量能够分布均匀(特别是对于精细的电化学实验),所以两个电极最好是平面且是对着的。在工作电极和辅助电极之前常用多孔玻璃隔开(即多室电解槽),一方面能够得到均匀的电流分布,此外也能减少辅助电极上的反应对工作电极的影响,其弊端是在一定程度上也增加了溶液电阻。
4) 电解质
一般电极反应在溶液中或在熔融盐(如提取铝)中发生。为了减小电场作用下电活性物质的迁移现象,加入高浓度的不参加电极反应的电解质是非常必要的,称为惰性电解质或支持电解质。电解质的浓度至少是电活性物质浓度的100倍,成为导电的主要离子。电解质可以是无机盐也可以是有机盐,酸或碱,或缓冲溶液(如柠檬酸盐、磷酸盐、醋酸盐等)。
某些支持电解质在水解溶液和部分非水溶液中的近似使用电势范围
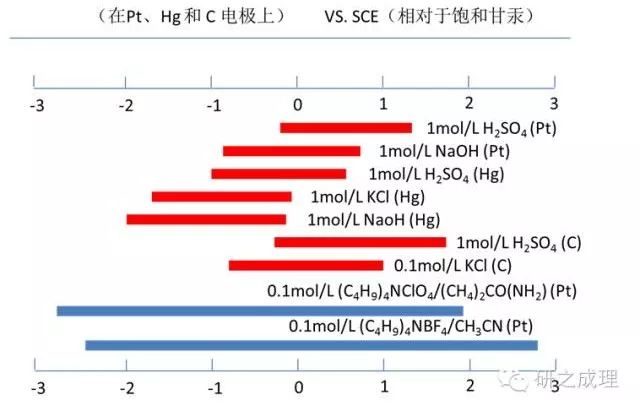
上图给出了部分水溶剂和非水溶剂中某些有用的支持电解质。溶剂和支持电解质使用的电势范围,在一定程度上其值也与所使用的电极材料有关,也即我们常说的电化学势窗。所有的情况必须保证支持电解质在实验所使用的电势范围内是惰性的,不能与电极或电极反应产物发生反应。在进行电化学测试前,必须进行potential window的确定,以防干扰电化学测量或损坏电极。
5) 电解池通气装置
很多电化学测量需要使用惰性气体除氧或特异性吸附某些气体(如CO、H2S、O2),电解池需要有进气和出气通道,进气管口应该在电解池底部,常接有烧结玻璃,使进入的气体变成小气泡,更易分散,出气口有水封,防止空气进入,或在实验过程中改为在溶液上方通气,防止气体干扰到实验的进行,又起到保护气的作用。
6) 电解池用盐桥
当被测电极体系的溶液与参比电极的溶液不同时,常用盐桥把参比电极和研究电极连接起来,可使它们之间形成离子导电通路。盐桥作用有两个:一个是减小液接电位;二是防止或减少研究和参比电极的溶液之间的相互污染。常用的盐桥的电解质是KCl,为了防止其他离子与Cl离子反应,也可用KNO3。一般用琼脂固定,做成U型,保存在饱和的盐桥内置溶液中。
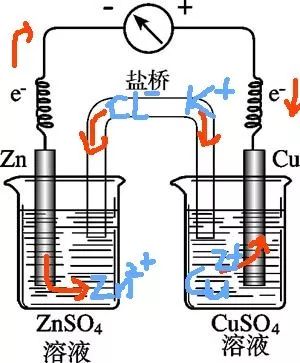
7) 电解池用鲁金毛细管
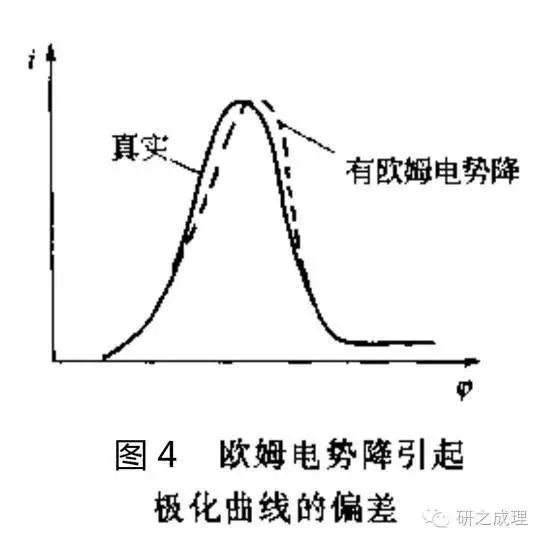
根据参比电极测量电位的原理我们可知,为了精确控制工作电极上的电势,参比和工作电极之间的电阻要尽量小,这时可以用鲁金毛细管。鲁金毛细管由玻璃管或塑料管做成,其一端拉得很细,极化测量中将此靠近被测量电极,另一端与参比电极相通。鲁金毛细管的位置不同,测得的工作电极的电位会略有差别,因为在工作电极和参比电极的毛细管之间,由极化电流和这段溶液电阻引起的欧姆电势降会附加到测量或控制的电势中去,造成误差(如图4)。所以毛细管口要尽量靠近工作电极,但也不能无限靠近,以防对工作电极表面的电力线分布造成屏蔽效应,一般情况下可将毛细管间端外径拉到0.5~0.1mm,使其尖嘴离工作电极表面的距离不小于毛细管间端外径。
2. 电解池的种类
在进行电化学测试前,电解池的设计是重要的一步,它直接影响到测试结果的准确性,电解池一般是指进行电化学测试的容器。电解池的设计种类繁多,关键是选择一款适合自己体系的电解池。常见的电解池如下图所示,它适合一般的电化学测试用。
按照电解槽中的研究电极和辅助电极是否隔开,可将电解槽分为单室电解槽(下图1)和双室电解槽(下图2)。像图1是一种用于腐蚀研究的单室电解池;图2是一种H型电解池,它将工作电极和辅助电极用隔膜隔开,可以有效防止在测试过程中辅助电极的产物对工作电极的影响。
根据电解时生成物的情况,电解可分以下几种类型:1.电解水型:含氧酸、强碱、活泼金属的含氧酸盐溶液的电解;2.分解电解质型:无氧酸(如HC1)、不活泼金属的无氧酸盐(如CuCl2)溶液的电解;3.放氢生碱型:活泼金属的无氧酸盐(如NaCl、MgBr2等)溶液的电解;4.放氧生酸型:不活泼金属的含氧酸盐(如CuSO4、AgNO3等)溶液的电解。
电解过程中的能量转化(装置特点) 阴极:一定不参与反应 不一定惰性电极 阳极:不一定参与反应 也不一定是惰性电极发生电解反应的条件 ①连接直流电源 ②阴阳电极 阴极:与电源负极相连为阴极 阳极:与电源正极相连为阳极 ③两极处于电解质溶液或熔融电解质中 ④两电极形成闭合回路
电化学重要公式及应用举例
1. 法拉第定律

对于法拉第电解定律,在实际中常常用到的是计算法拉第效率,也即施加的电流用于某一个电化学反应的比例。法拉第效率往往能反映出材料的选择性。
应用举例:图B给出了在CO2电还原中CO和H2的法拉第效率,在低电位下该材料对CO的选择性是很高的,到了高电位H2逐渐占据主导。两者相加大约是90%,那么如果认为总法拉第效率是100%,剩下的10%基本可归结为HCOOH,CH3OH等液体产物。S12给出了计算法拉第效率的公式。
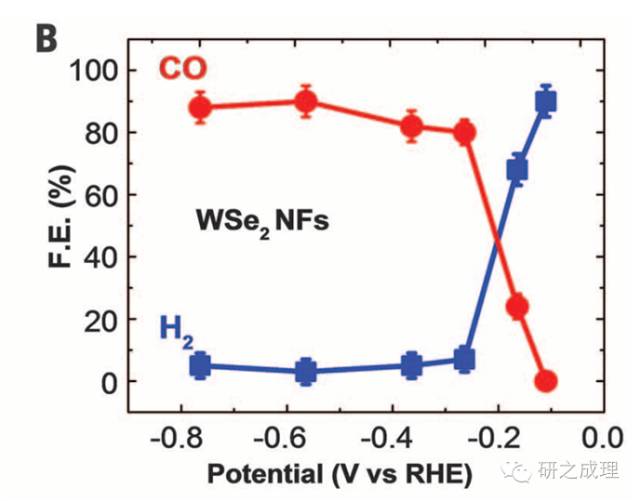
(B)CO and H2overall faradaic efficiency (FE) at different applied potentials for WSe2NFs.The error bars represent SD of four measurements.

参考文献:Asadi M, Kim K, Liu C, et al. Nanostructured transition metal dichalcogenide electrocatalysts for CO2 reduction in ionic liquid. Science 2016, 353(6298): 467-470.
2. 能斯特方程

由于Butler-Volmer方程和能斯特方程有一定的统一性,这里也介绍下B-V方程。


因此,对于能斯特方程,只有在动力学为0,即平衡状态下才试用。由于参比电极本身是个可逆性很高的电极,所以在实际中常常用能斯特方程来进行参比电极之间的换算。
应用举例:参比电极之间的换算。为了能与不同文献有对比性,往往我们会将相对参比电极的电势归一化到相对可逆氢电极的电势,而我们在做电化学实验的时候用的参比电极往往不是可逆氢电极,这时,我们就需要把实际测出来的电位换算到相对于可逆氢电极的电位。
还是上面那篇文献,实际用的是Ag/AgCl电极,需要转换成可逆氢电极RHE,supporting information给出了转换式子:

推导:
由于PH会影响RHE的电极电势,所以需要先对氢电极进行转化:

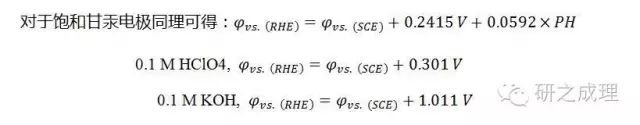
3. 塔菲尔公式
塔菲尔公式的数学表达式为: η=a+blogj
式中过电位和电流密度j均取绝对值(即正值),a和b称为塔菲尔常数,它的大小和电极材料的性质、电极表面状态、溶液组成及温度等因素有关,根据塔菲尔斜率的大小,可以比较不同电极体系中进行电子转移步骤的难易程度。
塔菲尔公式与B-V方程:

应用举例:塔菲尔曲线在电化学析氧中应用非常广泛,对于确定电子步骤的难易程度具有重要的价值。俄勒冈大学Boettcher课题组的J. Am. Chem. Soc., 2015, 137 (10),3638–3648一文中对于这个应用做了详细讨论:

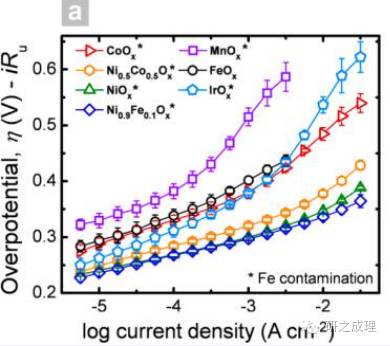
另一个方面,塔菲尔曲线也是一个直观地判别电催化剂活性的依据,对于OER而言,一般Tafel斜率越小,说明其活性越好,如下图所示,越靠向右下角的催化剂其活性越好(相同电流下过电位低)
-
原电池和电解池有什么区别?2024-05-21 10805
-
原电池与电解池的异同点2024-04-28 4958
-
原电池和电解池的区别2019-07-10 87740
-
电化学原理介绍和分析方法2017-10-16 11697
-
原电池电解池综合练习2009-11-06 1030
-
化学复习电化学基础—原电池2009-11-05 667
-
电化学-电池与电解2009-11-02 584
全部0条评论

快来发表一下你的评论吧 !

